

多黏菌素抑菌机理及耐药机制研究进展
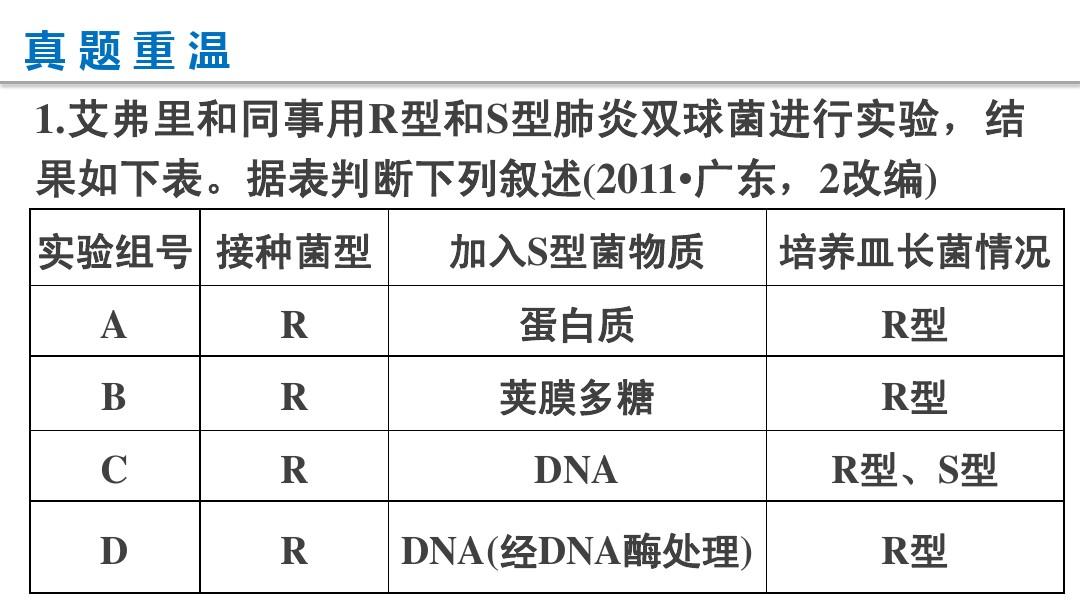
来源
中国药物刊物2019年7月第44卷第7期
作者
乔涵游雪甫李聪然
中国医学科大学上海协和医大学医药生物技术研究所
抗感染抗生素研究上海市重点实验室
摘要
多黏菌素是临床诊治多重耐药的革兰阳性菌感染的最后一道防线。
但随着多黏菌素在临床、畜牧业及农业上使用的逐年降低以及一些药物滥用情况的发生,造成其对革兰阳性菌的医治疗效相对升高,出现了多种多黏菌素耐药的革兰阳性菌。
本文就多黏菌素的抑菌机理、副作用机制、对不同耐药菌的耐药机制进行综述。
关键词
革兰阳性菌;多黏菌素耐药;mcr-1;耐药机制;副作用机制
正文
临床中药物的过度使用对真菌施加了强烈的选择压力,加速真菌形成药物耐药(nce,AMR)。
近些年来,真菌耐药问题,非常是多黏菌素耐药革兰阳性菌造成的感染,越来越遭到人们的广泛关注。
世界卫生组织的有关资料显示,全球每年约有70千人死于药物耐药菌引起的感染[1]。
多黏菌素类药物是医治多重耐药革兰阳性菌感染的最后一道防线,若医治真菌感染的最后一道防线也被真菌打破,人类将有可能步入前药物时代。
多黏菌素于1947年被发觉,是一种古老的抗生素,价钱低廉,它是由多黏芽孢球菌形成的一组有A~E等组分的环肽类药物[2]。
目前用于临床的产品主要是多黏菌素B和多黏菌素E的硝酸盐和甲磺酸盐。
多黏菌素由线性三肽部份联接N-脂肪硝基链和环状七肽构成,4-位L-Dab(α,γ-二苯基甘氨酸)与10-位L-Thr酯化产生七肽环。
多黏菌素B和多黏菌素E的结构非常相像,仅在6-位多肽上存在差异。
多黏菌素B的6-位是D-Phe,多黏菌素E的6-位是D-Leu(图1)[3]。
多黏菌素对大多数肠球菌科真菌有活性,包括肠球菌属,克雷伯菌属,葡萄柚酸弧菌属,沙门菌属和志贺菌属等,对常见非发酵性革兰阳性菌也有明显活性,包括鲍曼不动弧菌,铜绿假单胞菌和嗜麦芽寡养单胞菌[4]。
但一些菌株对多黏菌素天然具有抗性,包括变型菌属、摩氏摩根菌、普罗威登斯菌属、黏质沙雷菌、马来假单胞菌、洋葱伯克霍尔德菌、色球菌属、爱德华菌属、布鲁菌、军团菌、弯曲菌和鼠疫杆菌。
多黏菌素对革兰阳性杆菌(奈瑟杆菌属),革兰阴性菌和需氧菌没有活性[4]。由于多黏菌素抑菌谱窄,毒性大,所以最初应用于兽药和草料添加剂。
后来随着碳青霉烯类药物耐药菌的形成,多黏菌素也开始慢慢应用于临床诊治,并被誉为临床诊治多重耐药革兰阳性菌感染的最后一道防线。
随着多黏菌素应用的增多,有些真菌对其形成了耐药性,而多黏菌素耐药机制也成为了研究热点。
多黏菌素耐药的完整机制仍未完全阐述,但多黏菌素耐药现象的出现很可能与服药时间的延长及用用量的加强有关。
本文将从多黏菌素的抑菌机理、副作用形成机制、耐药机制等方面进行综述和讨论。
内容由凡默谷小编查阅文献选定,排版与编辑为原创。如转载,请尊重劳动成果,标明来始于凡默谷公众号。
多黏菌素抑菌作用机制
革兰阳性病菌外膜(outer,OM)的关键作用是作为渗透屏障[6]。
多黏菌素的原始靶标是外膜上的脂寡糖(,LPS)组分。
LPS由3个结构域组成,即脂类A、核心黄酮和O-抗体。
脂类A充当疏水端,脂肪硝基链的紧密堆积有助于稳定整个外膜的结构[7]。
多黏菌素通过与LPS的脂类A组分互相作用使病菌外膜私密性降低(图2)来发挥它们的抑菌作用。
多黏菌素的抑菌谱之所以窄,也是由于其只能与有限几种LPS结合引起[6,8-9]。
尽管LPS是最初的靶标,但多黏菌素的准确作用形式仍旧不清楚,目前已知的机制有以下几种。
1.1“自促摄入”机制
该机制是一个被广为认可的模型,该模型觉得多黏菌素两性性质对多黏菌素分子通过外膜屏障至关重要。
在这个模型中,多黏菌素Dab残基上游离的羟基在生理条件下发生质子化作用,并与类质A乙酸基阴离子(图3)形成静电吸引作用。
质子化的多黏菌素代替二价阳离子(Mg2+和Ca2+)来稳定脂寡糖层,多黏菌素分子的N-脂肪硝基链和6、7位疏水部份的插入,弱化了相邻脂类A脂肪硝基链的堆积,造成外膜双层的扩充,最终使外膜膨胀[10-11]。
此后,多黏菌素介导的外膜和细胞膜融合通过诱导磷脂交换实现,最终引致渗透失衡和细胞死亡[5]。
1.2多黏菌素介导的内膜和外膜的囊泡之间的接触
这一假定是基于多黏菌素B结合于阴离子磷脂囊泡,才能产生囊泡-囊泡接触的实验结果[11-12]。
这种接触才能促使囊泡之间的磷脂交换。
在革兰阳性菌中,多黏菌素B在周质空间中可以产生内膜和外膜之间的接触和脂类交换,而内外膜都含有磷脂酰甘油和心磷脂,由此形成的磷脂交换会增加其成份的差别细胞膜选择性通透,因而造成细胞渗透不平衡和细胞活力的失去[12]。
1.3抑制真菌内膜中重要的呼吸酶
通常来说真菌呼吸链由3个复合体组成,醌和还原型辅酶(NADH)作为在大蛋白质复合物之间穿梭电子和质子的载体来发挥作用[13]。
在复合物1中,已鉴别出NADH氧化酶家族的3种内膜呼吸酶:NDH-1、NDH-2和钠转运NADH-Q氧化还原酶[13-14]。
多黏菌素通过甲基自由基的释放含量依赖性地抑制革兰阳性菌内膜中NDH-2酶活性,从而诱导鲍曼不动链球菌和其他革兰阳性菌的快速杀灭[15]。
1.4抗内毒素作用
除直接抑菌活性外,多黏菌素还具有有效的抗内毒素活性。
革兰阳性病菌的内毒素是LPS分子的脂类A。
多黏菌素B结合并中和LPS的脂类A,阻断了LPS和完整细胞在孵育后诱导内毒素晕厥介质癌症坏死因子(TNF)的能力,进而有效保护了被革兰阳性菌所感染的寄主[16-17]。
多黏菌素的副作用机制
尽管多黏菌素对个别耐药的革兰阳性菌感染有着突出且不可取代的作用,但由于多黏菌素抑菌谱窄,毒性大等问题还是不能成为一个很理想的抗生素。
随着碳青霉烯类药物耐药菌的形成,多黏菌素不得不成为对抗多重耐药的革兰阳性菌的最后一道防线,但其明显的副作用包括神经毒性和肾毒性也是不可忽略的问题。
为此,多黏菌素临床使用时形成副作用的相死机制很有必要进行了解和阐述。
2.1神经毒性
神经毒性表现为腹痛、嗜睡、面部和周围组织觉得异常、眩晕、视力增长、共济失调和神经胸肌接头阻滞,可能造成呼吸衰竭或呼吸暂停,神经毒性是剂量依赖性和可逆性的。
分子伴侣HSP90是活细胞中必不可少的蛋白质之一[18-19]。
黏菌素对HSP90的ATP酶活性没有影响,且低含量不影响HSP90的分子伴侣活性[20],但黏菌素可特异性结合HSP90,通过N-端结构域诱导HSP90集聚,故学者们猜想神经毒性是因为脑部中高含量的黏菌素与HSP90的集聚,致使HSP90的失活,而HSP90的失活可能造成细胞功能的崩溃,而且可以间接诱导细胞自噬。
2.2肾毒性
肾毒性是最常见的不良反应,非常是对于新推荐的高剂量医治方案。
肾毒性主要包括急性肾小管坏死,表现为胆红素消除率增加,血浆尿素和尿酸水平下降。
与神经毒性类似,肾毒性也是剂量依赖型的,且在初期停药病症可逆。
黏菌素的肾毒性主要与其D-胺基乙酸和脂肪酸成份有关,肾毒性机制类似于它的抑菌作用:
(1)细胞膜毒性:黏菌素降低了肾小管上皮细胞膜的私密性,致使阳离子、阴离子和水分流入,导致细胞水肿和细胞溶化[21]。
(2)氧化应激损伤:指机体在须要消除体内老化的细胞,或在遭遇各类有害剌激时,体内高活性分子,如活性氧自由基(ROS)和活性氮(RNS)自由基形成过多,氧化程度超出氧化物的清理,氧化系统和抗氧化系统失衡,因而造成组织损伤[22]。维生素C、褪黑素及N-甲基半胱谷氨酸等抗氧化剂可保护黏菌素诱发的肾细胞脂类二溴化及自噬等副作用发生[23]。
(3)细胞自噬途径(即线粒体,死亡受体和叶绿体途径)和凋亡途径:植物及体外细胞模型研究否认,线粒体自噬通路、内质网自噬通路及死亡受体自噬通路参与黏菌素诱导的细胞自噬,且线粒体及死亡受体通路为黏菌素诱导细胞自噬的主要通路[24-25]。
(4)另外,黏菌素还可能通过抑制寄主核质和内质网体的功能糖体功能形成肾毒性。
内容由凡默谷小编查阅文献选定,排版与编辑为原创。如转载,请尊重劳动成果,标明来始于凡默谷公众号。
2.3其他毒性
黏菌素的其他不良反应包括过敏反应、皮疹、报道,黏菌素导致的过敏反应发生率约为2%[26]。
据悉,伪膜性结肠癌代表了黏菌素的另一副作用,虽然罕见,但也是黏菌素医治的潜在副作用。使用雾化黏菌素医治可能进一步加重支食道收缩和头晕。
但是,在开始用雾化黏菌素医治之前吸入β2兴奋剂诊治可以防治支食道收缩的发展。
脑室内给与黏菌素,非常是高剂量,可能造成败血症。但这种不良反应大多比较稀少,故其发生机制还有待研究。
多黏菌素耐药机制
随着多黏菌素耐药现象的出现和降低,耐药机制的研究已成为目前的一项热点问题。
多黏菌素耐药的完整机制仍未完全阐述,目前已明晰的主要有以下4种[27]:对外膜脂寡糖(LPS)结构进行修饰整修;屏障系统或低毒外排泵系统的活化;存在抗生素的降解蛋白;真菌的异质性耐药等[11,28-29]。
3.1对外膜脂寡糖(LPS)结构进行修饰改建
多黏菌素对革兰阳性菌作用的关键第一步是多黏菌素带正电的α,γ-二羟基乙酸(Dab)残基和脂类A上的带负电荷的乙酸官能团之间的静电互相作用[3,5]。
为此,许多真菌对多黏菌素耐药的机制是基于减少这些初始静电互相作用的脂类A背部官能团的修饰。
在大肠埃希菌、沙门菌血浆型鼠伤寒沙门菌、肺炎克雷伯菌和铜绿假单胞菌中,用带正电荷的官能团,比如4-甲基-4-脱氧-L-阿拉伯糖和/或乙酸乙酸胺修饰脂类A的乙酸盐,可降低净负电荷量而介导弧菌的多黏菌素耐药性(图4)。
这些修饰脂类A的机制又分为引物荨流感、全身性湿疹、发烧和重度肠道道疾患。据介导和染色体介导两种。
3.1.1引物介导的多黏菌素耐药机制
过去觉得,黏菌素的耐药机制是由染色体突变介导,并不能通过基因的水平转移导致耐药,但2015年首次在植物源大肠埃希菌(coli)中发觉了引物介导的黏菌素耐药基因mcr-1()[30],并通过体外接合试验证明了该基因可通过可接合性质粒在不同菌株间传播,介导低水平的黏菌素耐药。
mcr-1基因全长,GC浓度49%,坐落IncI2型引物上。
产物MCR-1蛋白宽度为541个多肽。
多肽序列剖析结果显示MCR-1与之前报导的乙酸乙酸胺转移酶家族有60%左右的相像性,与类芽孢球菌编码的乙酸乙酸胺转移酶的同源性达63%[30]。
乙酸乙酸胺转移酶可将乙酸乙酸胺官能团(PEtN)添加到脂寡糖表面的类脂A上,进而增加黏菌素与脂寡糖的静电作用,造成真菌对黏菌素耐药[31-32]。
通过ESI-MS剖析,否认MCR-1具有乙酸甲醇胺转移酶活性,即可催化乙酸乙酸胺与脂寡糖表面类脂A结合,介导黏菌素耐药[30]。
通过对MCR-1蛋白模拟结构剖析,MCR-1蛋白是一个膜结合蛋白,N端为膜结合域,富含5个疏水的跨膜α-螺旋结构,C端为亲水结构域。
跨膜结构域能固定MCR-1于细胞内膜的周质面,在细胞周质中完成对类脂A的共价修饰,同时强调MCR-1中的5个多肽残基(E246、T285、H395、D465和H466)可能与其底物结合活性相关[33]。
MCR-1与两个已知的可溶乙酸乙酸转移酶结构(图5)相像,分别为颞叶炎奈瑟菌的LptA和空肠弯曲弧菌的EptC[30]。
除mcr-1外,2016年6月在德国大肠埃希菌中鉴别出一种新型引物介导的黏菌素抗性基因mcr-2[34]。
mcr-2基因长,比mcr-1短9个核苷酸,与mcr-1具有76.75%的同源性。
MCR-1和MCR-2蛋白显示80.65%的同源性。
2017年4月,第三个联通黏菌素抗性基因mcr-3被发觉[35]。
mcr-3基因全长,分别与mcr-1和mcr-2显示45.0%和47.0%的碱基序列同源性。
MCR-3的多肽序列分别与MCR-1和MCR-2具有32.5%和31.7%的多肽同源性。
2017年在mcr-3发觉不久,mcr-4也被发觉,其基因全长[36]。
2017年12月,有被称为mcr-5()的基因被发觉[37],它是Tn3家族的转座子的一部份,但是一般坐落相关的多拷贝ColE型引物上。
mcr-5与mcr-1和mcr-2有81.23%的多肽序列同源性而且被觉得都起源于莫拉菌属。
而MCR-5与MCR-1、MCR-2、MCR-3和MCR-4的蛋白质序列同源性分别为36.11%、35.29%、34.72%和33.71%[37]。
内容由凡默谷小编查阅文献选定,排版与编辑为原创。如转载,请尊重劳动成果,标明来始于凡默谷公众号。
3.1.2染色体介导的多黏菌素耐药机制
对于奇特变型菌和黏质沙雷菌,对多黏菌素的天然耐药与乙酸乙酸胺(pEtN)或4-羟基阿拉伯糖(L-Ara4N)阳离子络合物修饰LPS的脂类A有关。
这些修饰降低了多黏菌素初始靶标LPS的电荷,因而增加了多黏菌素的结合,造成这种菌种的固有耐药[38-40]。
对于肠球菌科真菌,也是向LPS添加阳离子络合物(如L-Ara4N和pEtN),与其有关的基因包括编码直接参与LPS修饰的酶基因和操纵子(负责合成阳离子络合物和/或将其添加到LPS)。如:
(1)pmrC基因:操纵子编码3种蛋白质,即乙酸乙酸胺转移酶PmrC,反应调节剂PmrA(俗称为BasR)和传感激酶蛋白PmrB(俗称为BasS)[41]。
(2)pmrE基因和操纵子(俗称或pbgPE操纵子):负责L-胺基阿拉伯糖络合物(L-Ara4N)的合成及其对脂类A的固定[42]。
(3)pmrA和pmrB基因:PmrB是具有丝氨酸激酶活性的蛋白质,其通过乙酸化来激活PmrA。PmrA依次激活参与LPS修饰的操纵子,操纵子和pmrE基因的转录[41]。
(4)phoP和phoQ基因:PhoQ是一种具有丝氨酸激酶活性的蛋白质,通过乙酸化活化PhoP。PhoP反过来激活操纵子的转录,参与将L-Ara4N添加到LPS的脂类A上[43-44]。PhoP也可以通过PmrD联接蛋白直接或间接激活PmrA蛋白,造成pEtN添加到LPS中。
(5)mgrB基因:MgrB(亦称为YobG)是47个多肽的小跨膜蛋白。PhoP激活后,mgrB基因下调。MgrB蛋白抑制PhoQ编码基因的抒发,因而MgrB蛋白对phoPQ操纵子有负反馈作用。而mgrB基因的失活造成phoPQ操纵子的过抒发,从而导致操纵子活化,造成L-Ara4N修饰LPS作用而形成耐药[45-46]。
(6)crrAB操纵子:crrAB操纵子编码两种蛋白质,调节蛋白CrrA和传感蛋白激酶CrrB。crrB基因的失活造成pmrAB操纵子的过抒发,进而造成操纵子及pmrC和pmrE基因的激活,最终造成真菌获得黏菌素耐药性。CrrB失活也可能通过激活糖基转移酶样蛋白来修饰脂类A[47-48]。
(7)ParRS、ColRS和CprRS3种双组分体系:ParRS(多黏菌素适应性耐药)双组分体系与多黏菌素的适应性耐药有关[49]。
该系统突变引起操纵子的组成形抒发细胞膜选择性通透,并因而造成L-Ara4N添加至LPS造成黏菌素耐药。
ColRS和CprRS系统的作用可能通过激活phoQ基因或通过其他基因造成黏菌素耐药[50]。
3.2屏障系统改变或低毒外排泵系统的活化
除对LPS的修饰作用外,还有一些其他机制,如:
(1)荚膜寡糖(CPS)形成降低:一项研究表明,CPS可作为淋病克雷伯菌抗多黏菌素的保护屏障[51],CPS在真菌表面释放阴离子,这种阴离子与多黏菌素结合,进而降低多黏菌素与LPS的结合,使病菌菌体遭到保护[52],形成多黏菌素耐药。
(2)内在调节器RamA:它调节与渗透性障碍相关的基因,因而可能参与减少对药物的易感性。这些调节因子水平的下降导致LPS的改变,进而增加了对多黏菌素的易感性[53]。
(3)膜孔蛋白的作用:ydeI基因编码14kDa的多肽/寡核酸结合折叠蛋白(OB-折叠蛋白),这些OB-折叠蛋白可与膜孔蛋白(OmpD/NmpC:三聚体β-折叠外膜孔蛋白家族成员)互相作用进而降低真菌对多黏菌素的抗性,如肝脏沙门菌对多黏菌素的抗性[54]。
(4)外排泵的作用:外排泵的编码组分kpnEF和acrAB的突变可造成黏菌素MIC明显增加[55-56]。在低剂量外排泵抑制剂甲基溴化间甲苯腙(CCCP)中培养耐药菌,可减少耐药弧菌的MIC(降低128~512倍),并部份或完全抑制抗性亚群的再生[57]。
(5)脂类A生物合成基因(lpxA、lpxC和lpxD基因)改变:这种基因可能被插入序列如所替换、截断、移码或插入失活,导致的LPS完全失去,最终造成多黏菌素耐药[58-59]。
3.3存在抗生素的降解蛋白
乘以上机制外,还有一种直接的耐药机制,就是真菌还能形成降解多黏菌素的酶,进而降解多黏菌素,使其不能与真菌的脂类A互相作用。
因为多黏菌素本身属于一种氨基酸类药物,因而才能将其降解的也应是蛋白酶。2018年学者们从若干蛋白酶形成菌中筛选得到高效降解黏菌素的地衣芽孢球菌DC-01[60]。
该菌种可在23~44℃之间形成黏菌素降解酶,但因为未做进一步确证,还不知编码该蛋白酶的基因坐落引物还是染色体中,但仍应当提升提防以防一些革兰阳性菌获得生产该酶的能力因而导致黏菌素耐药。
3.4真菌的异质性耐药
异质性耐药是真菌耐药的一种特殊类型,说的是一种表面上同源的真菌,表现出对特定药物部份敏感的现象[61],即在体外的常规药敏试验中,弧菌表现为敏感,倘若改用特殊方式测量,则可以发觉细胞的大部份亚群属于敏感,但有一小部份亚群属于耐药,极少数亚群甚至表现为高水平耐药,这部份耐药亚群可以造成临床药物医治失败[62]。
(1)鲍曼不动球菌对黏菌素异质性耐药的机制可能与LPS或/和PmrAB双组分系统的失去有关[63]。
(2)芹菜伯克霍尔德菌对多黏菌素B的异质性耐药取决于硫酸二丁胺分泌水平和YceI的不同。因为硫酸二丁胺具有挥发性,因而也可以以挥发性介导的形式将抗性传递给数学分离的真菌[64]。
(3)铜绿假单胞菌对多黏菌素的异质性耐药也与多胺有关[65]。
总结与展望
多黏菌素到目前为止还是临床诊治多重耐药革兰阳性菌感染的最后一道防线。
因而探求多黏菌素的作用机制和副作用机制,以开发愈发有效且副作用更小的多黏菌素类似物;探求多黏菌素的耐药机制,以发觉更有效的对抗耐药的靶向都是极为必要的。
本文中论述的机制希望可以对临床诊治和基础探究以及对抗多黏菌素耐药起到部份指导作用。
参考文献
详见中国药物刊物2019年7月第44卷第7期